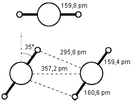
Гидрид ртути(II)
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 августа 2016 года; проверки требуют 10 правок.
| Гидрид ртути(II) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Гидрид ртути(II) | ||
| Традиционные названия | Водородистая ртуть | ||
| Хим. формула | HgH2 | ||
| Физические свойства | |||
| Состояние | белый порошок | ||
| Молярная масса | 202,60 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • разложения | -90 °C | ||
| Классификация | |||
| PubChem | 19021138 | ||
| SMILES | |||
| InChI | |||
| Безопасность | |||
| Токсичность | яд | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Гидрид ртути(II) — неорганическое соединение металла ртути и водорода с формулой HgH2, белый порошок, термически очень неустойчивый, ядовитый.
Получение[править | править код]
- Реакция иодида ртути(II) с алюмогидридом лития в диэтиловом эфире при низкой температуре:
Физические свойства[править | править код]
Гидрид ртути(II) образует белый объёмный порошок, ядовит.
Химические свойства[править | править код]
- Разлагается при незначительном нагревании:
Токсичность[править | править код]

Яд. Как и любое соединение ртути, ее гидрид очень ядовит. Очень неустойчив и существует лишь при -90°C и ниже, разлагается с выделением ядовитой ртути. Способен вызвать тяжелые отравления ртутью и ее парами, и даже к смерти.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |