Оксид церия(III)
| Оксид церия(III) | |
|---|---|
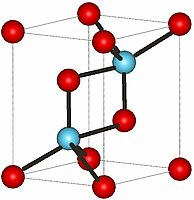 | |
| Общие | |
| Систематическое наименование |
Оксид церия(III) |
| Хим. формула | Ce2O3 |
| Физические свойства | |
| Молярная масса | 328,24 г/моль |
| Плотность | 6,2 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2177 °C |
| Структура | |
| Координационная геометрия | P-3m1, No. 164 |
| Кристаллическая структура | шестиугольная |
| Классификация | |
| Рег. номер CAS | [1345-13-7] |
| PubChem | 9905479 |
| Рег. номер EINECS | 215-718-1 |
| SMILES | |
| InChI | |
| ChemSpider | 8081132 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид церия(III) — оксид редкоземельного металла церия. Химическая формула — , цвет — золотисто-жёлтый.
Применение[править | править код]
Катализатор выхлопных газов[править | править код]
Оксид церия используется как каталитический конвертер для сокращения выбросов CO в выхлопных газах автотранспортных средств[источник не указан 227 дней].
Когда не хватает кислорода, оксид церия(IV) восстанавливается оксидом углерода(II) до оксида церия(III):
- .
Если есть избыток кислорода, оксид церия(III), наоборот, окисляется до оксида церия(IV):
Расщепление воды[править | править код]
Цикл — двухшаговое термохимическое расщепление воды[1].
Освещение[править | править код]
Оксид церия(III) в сочетании с оксидом олова(II) () в керамической форме используется для освещения с УФ-излучением. Поглощает свет с длиной волны 320 нм и излучает свет с длиной волны 412 нм[2]. Такое сочетание оксида церия(III) и оксида олова(II) является редкостью, и получается с большим трудом в лабораторных условиях[источник не указан 227 дней].
Получение[править | править код]
Оксид церия(III) получают восстановлением оксида церия(IV) с помощью водорода при около 1400 °C[3].
Примечания[править | править код]
- ↑ Hydr. Prod. from S-T. Hydrogen Production from Solar Thermochemical Water Splitting Cycles (англ.). SolarPaces (30 августа 2009). Дата обращения: 5 июня 2023. Архивировано 30 августа 2009 года.
- ↑ D. R. Peplinski, W. T. Wozniak, J. B. Moser. Spectral studies of new luminophors for dental porcelain // Journal of Dental Research. — 1980-09. — Т. 59, вып. 9. — С. 1501–1506. — ISSN 0022-0345. — doi:10.1177/00220345800590090801. Архивировано 6 июня 2023 года.
- ↑ Georg Brauer. Handbook of Preparative Inorganic Chemistry (англ.). — Academic Press, 1965. — Vol. 2. — P. 1151. — 1859 p. — ISBN 978-0-12-126601-1. Архивировано 6 июня 2023 года.
В статье не хватает ссылок на источники (см. рекомендации по поиску). |




