Реакция Манниха
Реакция Манниха — метод аминометилирования енолизующихся карбонильных соединений с образованием β-аминокарбонильных соединений — оснований Манниха.
Реакция открыта в 1912 году Карлом Маннихом при действии формальдегида и вторичных аминов на кетоны (первоначально — антипирин)[1]:
В настоящее время реакция Манниха используется для аминометилирования не только карбонильных соединений, но и различных C-нуклеофилов — алифатических нитросоединений, ацетиленов, α-алкилпиридинов, фенолов, электронизбыточных гетероциклических соединений, при этом аминоалкилирование может происходить как действием смеси неенолизирующегося альдегида и вторичного амина, так и действием иминиевых солей.
Механизм[править | править код]
В классическом варианте реакция Манниха - это трёхкомпонентная конденсация, в которой участвуют кетон, формальдегид и вторичный амин, либо в условиях кислотного катализа.
Взаимодействие формальдегида и амина ведёт к образованию соли α-метилоламина, которая отщепляет воду, образуя диалкилметилениминиевую соль, являющуюся сильным электрофилом:
В свою очередь, в условиях кислой среды происходит енолизация кетона с образованием нуклеофильного енола:
после чего иминиевый ион атакует C-нуклеофильный центр енола с образованием основания Манниха:
Модификации[править | править код]
Кроме смеси формальдегида и вторичного амина, образующих иминиевую соль, для проведения реакции Манниха используются и их синтетические эквиваленты, например, бис(диметиламино)метан, который при обработке трифторуксусной кислотой образует трифторацетат диметилметилидениминиевой соли, являющийся активным электрофилом:
- ,
аналогичным образом бис(диметиламино)метан применяется в комбинации и с другими кислотами (в частности, фосфорной при диаминометилировании ферроцена[2]).
Поскольку в классическом варианте реакция Манниха происходит с выделением воды и, как правило, в кислотных условиях, то в некоторых случаях в реакции в качестве электрофильного агента используются заранее синтезированные иминиевые соли, например, коммерчески доступную соль Эшенмозера (йодид диметилметилиденаммония H2C=N+(CH3)2 I-). Использование таких солей снимает ограничения классического варианта реакции Манниха и позволяет проведение диаминометилирования в некислотных и безводных условиях, например, в случае образуемых in situ силилированных эфиров енолов либо при взаимодействии с литийорганическими соединениями:
В качестве CH-кислотных компонент в реакции Манниха кроме карбонильных соединений могут быть использованы алифатические нитросоединения:
и электронизбыточные ароматические (например, фенолы, ферроцены) и гетероциклические соединения; так, например, диаминометилирование индола по Манниху ведёт к образованию алкалоида грамина:
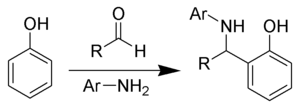
Ещё одним вариантом реакции Манниха, в которой вместо комбинации формальдегида с первичными алифатическими аминами используется комбинация ароматических альдегидов и аминов является аминобензилирование фенолов по Бетти[3]:
При замене вторичных аминов на тиолы протекает реакция, аналогичная в реакции Манниха, ведущая к образованию замещенных сульфидов, в роли CH-компонент в этой модификации выступают электронобогащенные ароматические и гетероциклические соединения (β-нафтол, индол)[4]:
Синтетическое применение[править | править код]
Продукты реакции — основания Манниха — нашли широкое применение в органическом синтезе.
Так, метилированием оснований Манниха с дальнейшим расщеплением по Гофману образовавшихся четвертичных аммониевых солей является методом синтеза енонов (α-метиленкарбонильных соединений):
Такой подход использовался, в частности, для введения в метиленового фрагмента в α-положение по отношению к альдегидной группе при синтезе бреветоксинов A[5] и B[6].
Реакция Манниха широко применяется в синтезе гетероциклических соединений — в том числе и при биомиметическом синтезе природных соединений как метод построения углеродного или гетероциклического скелета. Так, синтез тропинона по Робинсону из янтарного диальдегида, ацетондикарбоновой кислоты и метиламина представляет собой модифицированный вариант реакции Манниха, в которой циклическая иминиевая соль, образующаяся из янтарного диальдегида, алкилирует енольную форму ацетондикарбоновой кислоты[7]:
Другим примером являются различные методы аннелирования с использованием внутримолекулярной реакции Манниха, например, синтез пирролизидинового ядра[8]:
или синтез 1,2,3,4-тетрагидроизохинолинов по Пикте-Шпенглеру[9]:
Примечания[править | править код]
- ↑ Mannich, C.; W. Krösche. Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin (нем.) // Archiv der Pharmazie : magazin. — 1912. — Bd. 250, Nr. 1. — S. 647—667. — ISSN 1521-4184 0365-6233, 1521-4184. — doi:10.1002/ardp.19122500151.
- ↑ Daniel Lednicer and Charles R. Hauser. N,N-Dimethylaminomethylferrocene methiodide. Organic Syntheses, Coll. Vol. 5, p.434 (1973); Vol. 40, p.31 (1960). Архивная копия от 20 октября 2012 на Wayback Machine
- ↑ M. Betti. β-Naphthol phenylaminomethane. Organic Syntheses, Coll. Vol. 1, p.381 (1941); Vol. 9, p.60 (1929). Архивная копия от 14 мая 2011 на Wayback Machine
- ↑ Poppelsdorf, F.; S. J. Holt. Reactions of thiols and thioethers. Part I. An analogue of the Mannich reaction involving thiols, formaldehyde, and active methylene or methylidyne compounds (англ.) // Journal of the Chemical Society : journal. — Chemical Society, 1954. — 1 January (no. 0). — P. 1124—1130. — ISSN 0368-1769. — doi:10.1039/JR9540001124. Архивировано 12 января 2015 года.
- ↑ Crimmins, Michael T; J Lucas Zuccarello, J Michael Ellis, Patrick J McDougall, Pamela A Haile, Jonathan D Parrish, Kyle A Emmitte. Total synthesis of brevetoxin A (неопр.) // Organic letters. — 2009. — 15 January (т. 11, № 2). — С. 489—492. — ISSN 1523-7052. — doi:10.1021/ol802710u.
- ↑ Nicolaou, K. C.; F. P. J. T. Rutjes, E. A. Theodorakis, J. Tiebes, M. Sato, E. Untersteller. Total Synthesis of Brevetoxin B. 2. Completion (англ.) // J. Am. Chem. Soc. : journal. — 1995. — Vol. 117, no. 3. — P. 1173—1174. — ISSN 0002-7863. — doi:10.1021/ja00108a052.
- ↑ Robinson, Robert. LXIII. A synthesis of tropinone (англ.) // Journal of the Chemical Society : journal. — Chemical Society, 1917. — Vol. 111. — P. 762. — ISSN 0368-1645. — doi:10.1039/ct9171100762.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — p. 305.
- ↑ Whaley, W. M.; Govindachari, T. R. The Pictet-Spengler synthesis of tetrahydroisoquinolines and related compounds (англ.) // Org. React. : journal. — 1951. — Vol. 6. — P. 74.











![{\displaystyle {\mathsf {XC(O)CHRCH_{2}N^{+}(CH_{3})_{3}I^{-}{\xrightarrow[{}]{B^{-}}}XC(O)CR{\text{=}}CH_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/801939733ddedd8883d5c9f89c5f701d12b437b9)


