Тройная точка


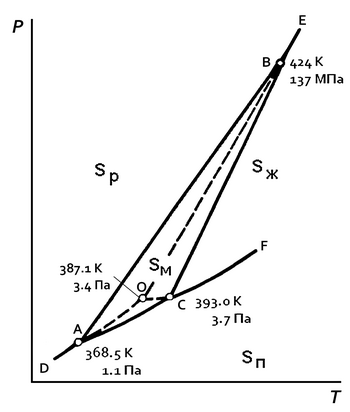
Sp — ромбическая сера; Sм — моноклинная сера; Sж — жидкая сера; Sп — пары серы


Тройна́я то́чка в однокомпонентной системе — точка схождения кривых двухфазных равновесий на плоской P—T-фазовой диаграмме, соответствующая устойчивому равновесию трёх фаз[1][2]. Тройная точка нонвариантна, т. е. не допускает изменения ни одного из характеризующих её параметров состояния — ни температуры, ни давления[3][4]. Индивидуальные вещества могут иметь несколько стабильных кристаллических фаз и вследствие этого несколько тройных точек[5]. В системе, способной к образованию N фаз, число возможных тройных точек равно [6]. Например, для серы известны четыре фазы — две твёрдые, жидкая и газообразная — и четыре тройные точки, одна из которых метастабильная[7][8][9][6].
Если для индивидуального вещества существует тройная точка, соответствующая состоянию, в котором равновесные фазы находятся в различных агрегатных состояниях (твёрдом, жидком и газообразном), то она единственна[10][11], и её называют основной тройной точкой[12][13][14] или фундаментальной точкой[15]. Основная тройная точка не существует для гелия[16].
Поскольку координаты тройной точки задаются значениями P и T и не зависят от V, то на трёхмерной фазовой диаграмме P—T—V и её проекции на плоскость P—V равновесным состояниям трёх фаз соответствует тройная линия (triple line)[17][18].
В основной тройной точке сходятся три моновариантные линии двухфазных равновесий: плавления (равновесие кристалл — жидкость), кипения (равновесие жидкость — пар) и возгонки (равновесие кристалл — пар)[3]. Гелий 3Не и 4Не не имеют основной тройной точки — в обоих случаях линии равновесия твёрдой фазы с жидкими (Не I и Не II) и жидких фаз с газообразной нигде не пересекаются: твёрдая фаза находится в равновесии только с жидкой[19][20][16]. Другие вещества с такой особенностью неизвестны[20].
Единственность и нонвариантность основной тройной точки позволяет использовать её как репер температуры. В частности, температурная шкала Кельвина использует тройную точку воды в качестве опорной.
Правило фаз Гиббса ограничивает число сосуществующих фаз — однокомпонентная система в равновесии не может иметь больше трёх фаз[1][2], — но не накладывает ограничений на их агрегатное состояние. Поэтому в случае энантиотропии на диаграмме состояния помимо основной тройной точки появляются дополнительные тройные точки, отвечающие:
- равновесию двух твёрдых фаз с жидкостью (например, аллотропных модификаций кристаллической серы — ромбической и моноклинной — и жидкой серы);
- равновесию двух твёрдых фаз с паром;
- равновесию трёх твёрдых фаз.
Возможно также появление метастабильных тройных точек, расположенных на пересечении линий метастабильных двухфазных равновесий (или продолжений этих линий). В случае монотропии появляется только метастабильная тройная точка[3].
Кристаллическая элементарная сера диморфна, поэтому на фазовой диаграмме серы (см. рисунок; для давления использован логарифмический масштаб) имеются три стабильные тройные точки и одна метастабильная, каждая из которых отвечает условиям термодинамического равновесия трёх фаз[21]:
- точка А (дополнительная): равновесие твёрдой ромбической Sp, твёрдой моноклинной Sм и газообразной серы Sп;
- точка В (дополнительная): равновесие твёрдой ромбической, твёрдой моноклинной и жидкой серы Sж;
- точка С (основная): равновесие твёрдой моноклинной, расплавленной и газообразной серы;
- точка О (метастабильная): метастабильное равновесие между перегретой твёрдой ромбической, переохлаждённой жидкой и газообразной серой.
Как показывает фазовая диаграмма, ромбическая сера не может одновременно находиться в равновесии с расплавом и парами серы[22], поэтому в основной тройной точке твёрдая фаза представлена моноклинной серой. Метастабильная тройная точка появляется вследствие низкой скорости превращения одной кристаллической модификации серы в другую[23].
В дополнительных тройных точках гелия сосуществуют либо две жидкие фазы (Не I и Не II) и кристаллический гелий, либо две жидкие фазы и газообразный гелий[24]. Для воды в 1975 г. были известны семь дополнительных тройных точек, из них три — для трёх твёрдых фаз[25]. Современные данные см. в статье Фазовая диаграмма воды и на приведённой в этой статье диаграмме.
При увеличении числа компонентов системы (раствора или сплава) увеличивается и число независимых параметров, характеризующих эту систему. Для описания двухкомпонентной системы к температуре и давлению добавляют третий параметр, характеризующий состав системы. Нонвариантной в бинарной системе будет четверная точка. Например, в системе из воды и соли одновременно в равновесии могут быть фазы: раствор, соль, лёд и пар (точка А на рис. Четверные точки в двухкомпонентной системе). Если соль образует кристаллогидраты, то возможны другие комбинации четырёх фаз, например раствор, соль безводная, твёрдый кристаллогидрат, лёд (или вместо льда пар) и т. д.(точка В на рис. Четверные точки в двухкомпонентной системе)[4][26]. Трёхмерная диаграмма состояния бинарной системы имеет уже множество тройных точек, расположенных на тройной пространственной кривой. На плоской диаграмме равновесие трёх фаз для такой системы можно отобразить, если считать один из параметров постоянным. В общем случае тройные точки существуют на плоских диаграммах состояния систем с любым числом компонентов, если все параметры, определяющие состояние системы, кроме двух, фиксированы[1].
В трёхкомпонентной системе тройной точкой называют нонвариантную точку четырёхфазного равновесия расплава с тремя твёрдыми фазами (тройная эвтектическая точка, точка тройной эвтектики)[3][27][28].
Параметры тройной точки некоторых веществ[править | править код]
Параметры тройной точки некоторых веществ приведены в таблице[29][30].
| Вещество | Фазы | Температура, °С | Давление, МПа |
|---|---|---|---|
| Ar (аргон) | твёрдая—жидкая—газовая | —189,34 | 0,0689 |
| Br2 (бром) | твёрдая—жидкая—газовая | —7,25 | 0,0046548 |
| С (углерод) | графит—алмаз—жидкость | 3700 | 11000 |
| Cl2 (хлор) | твёрдая—жидкая—газовая | —101,05 | 0,001354 |
| F2 (фтор) | твёрдая—жидкая—газовая | —219,61 | 0,00019198 |
| H2 (водород) | твёрдая—жидкая—газовая | —259.19 | 0,007205 |
| Kr (криптон) | твёрдая—жидкая—газовая | —157,22 | 0,073 |
| N2 (азот) | твёрдая—жидкая—газовая | —210,01 | 0,012520 |
| Ne (неон) | твёрдая—жидкая—газовая | —248,61 | 0,043265 |
| Rn (радон) | твёрдая—жидкая—газовая | —71 | 0,07 |
| Ti (титан) | 640 ± 50 | (8 ± 0,7)•1000 | |
| Tl (таллий) | α—β—γ | 115 | 3900 |
| Xe (ксенон) | твёрдая—жидкая—газовая | —111,63 | 0,08 |
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 3 Физическая энциклопедия. Тройная точка. Дата обращения: 19 апреля 2015. Архивировано из оригинала 21 апреля 2017 года.
- ↑ 1 2 Большая Советская Энциклопедия. Тройная точка. Дата обращения: 19 апреля 2015. Архивировано из оригинала 6 июня 2017 года.
- ↑ 1 2 3 4 Химическая энциклопедия, т. 5, 1998, с. 12.
- ↑ 1 2 Мюнстер А., Химическая термодинамика, 1971, с. 151.
- ↑ Хачкурузов Г. А., Основы общей и химической термодинамики, 1979, с. 132.
- ↑ 1 2 IUPAC Gold Book, 2014, p. 1567.
- ↑ Мейер К., Физико-химическая кристаллография, 1972, с. 133—134.
- ↑ Булидорова Г. В. и др., Физическая химия, 2012, с. 228.
- ↑ Иванова Т. Е., Химическая термодинамика и ее применение в нефтегазовом деле, 2014, с. 87.
- ↑ Жданов Л. С., Жданов Г. Л., Физика, 1984, с. 119.
- ↑ Мякишев Г. Я., Синяков А. З., Физика. Молекулярная физика. Термодинамика, 2010, с. 310.
- ↑ Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин, 1984, с. 22.
- ↑ Новиков И. И., Термодинамика, 1984, с. 215.
- ↑ Романюк В. Н. и др., Лабораторные работы (практикум) по дисциплине «Техническая термодинамика», ч. 2, 2003, с. 21.
- ↑ Леонова В. Ф., Термодинамика, 1968, с. 144.
- ↑ 1 2 Глаголев К. В., Морозов А. Н., Физическая термодинамика, 2007, с. 241.
- ↑ Хейвуд Р., Термодинамика равновесных процессов, 1983, с. 99.
- ↑ Техническая термодинамика. Под ред. Э. И. Гуйго, 1984, с. 146.
- ↑ Мюнстер А., Химическая термодинамика, 1971, с. 222.
- ↑ 1 2 Жданов Л. С., Жданов Г. Л., Физика, 1984, с. 121.
- ↑ Булидорова Г. В. и др., Физическая химия, 2012, с. 228.
- ↑ Ансельм А. И., Основы статистической физики и термодинамики, 1973, с. 227.
- ↑ Мейер К., Физико-химическая кристаллография, 1972, с. 134.
- ↑ Глаголев К. В., Морозов А. Н., Физическая термодинамика, 2007, с. 242.
- ↑ Эйзенберг Д., Кауцман В., Структура и свойства воды, 1975, с. 95—96.
- ↑ Раковский А. В., Курс физической химии, 1939, с. 276.
- ↑ Еремин Е. Н., Основы химической термодинамики, 1978, с. 329.
- ↑ Бобкова Н. М., Физическая химия тугоплавких материалов, 2007, с. 103.
- ↑ Дриц М. Е. и др., Свойства элементов, 1985.
- ↑ Фёдоров П. И., Тройная точка, 1998, с. 12.
Литература[править | править код]
- Nic M., Jirat J., Kosata B., Jenkins A. IUPAC Compendium of Chemical Terminology (Gold Book) (англ.). — 2.3.3. — International Union of Pure and Applied Chemistry, 2014. — 1622 p. — ISBN 0-9678550-9-8.
- Ансельм А. И. Основы статистической физики и термодинамики. — М.: Наука, 1973. — 424 с.
- Бобкова Н. М. Физическая химия тугоплавких неметаллических и силикатных материалов. — Минск: Вышэйшая школа, 2007. — 303 с. — ISBN 978-985-06-1389-9.
- Булидорова Г. В., Галяметдинов Ю. Г., Ярошевская Х. М., Барабанов В. П. Физическая химия. — Казань: Изд-во Казан. нац. исслед. технол. ун-та, 2012. — 396 с. — ISBN 978-5-7882-1367-5.
- Глаголев К. В., Морозов А. Н. Физическая термодинамика. — 2-е изд., испр. — М.: Изд-во МГТУ им. Н. Э. Баумана, 2007. — 270 с. — (Физика в техническом университете). — ISBN 978-5-7038-3026-0.
- Дриц М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. Справочник / Под общ. ред. проф. М. Е. Дрица. — М.: Металлургия, 1985. — 672 с.
- Еремин Е. Н. Основы химической термодинамики. — 2-е изд. — М.: Высшая школа, 1978. — 392 с.
- Жданов Л. С., Жданов Г. Л. Физика для средних специальных учебных заведений. — 4-е изд., испр. — М.: Наука, 1984. — 512 с.
- Иванова Т. Е. Химическая термодинамика и ее применение в нефтегазовом деле. — Тюмень: ТюмГНГУ, 2014. — 146 с. — ISBN 978-5-9961-0925-8.
- Мейер К. Физико-химическая кристаллография. — Пер. с нем. О. П. Никитиной. — Под ред. Е. Д. Щукина и Б. Д. Сумма. — М.: Металлургия, 1972. — 480 с.
- Леонова В. Ф. Термодинамика. — М.: Высшая школа, 1968. — 159 с.
- Мякишев Г. Я., Синяков А. З. Физика. Молекулярная физика. Термодинамика. 10 класс. Профильный уровень. — 12-е изд., стереотип.. — М.: Дрофа, 2010. — 349 с. — ISBN 978-5-358-08873-3.
- Мюнстер А. Химическая термодинамика. — М.: Мир, 1971. — 296 с.
- Новиков И. И. Термодинамика. — М.: Машиностроение, 1984. — 592 с.
- Раковский А. В. Курс физической химии. — М.: Госхимиздат, 1939. — 544 с.
- Романюк В. Н., Томкунас Е. В., Баук И. В., Тарасевич Л. В. Лабораторные работы (практикум) по дисциплине «Техническая термодинамика» для студентов теплоэнергетических специальностей. В 4-х частях. Часть 2. Реальный газ. — Минск: БелНТУ, 2003. — 104 с.
- Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин / Отв. ред. И. И. Новиков. — АН СССР. Комитет научно-технической терминологии. Сборник определений. Вып. 103. — М.: Наука, 1984. — 40 с.
- Техническая термодинамика / Под ред. проф. Э. И. Гуйго. — 2-е изд. — Л.: Изд-во Ленингр. ун-та, 1984. — 296 с.
- Фёдоров П. И. Тройная точка // Химическая энциклопедия. — Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 12.
- Хачкурузов Г. А. Основы общей и химической термодинамики. — М.: Высшая школа, 1979. — 268 с.
- Хейвуд Р. Термодинамика равновесных процессов. Руководство для инженеров и научных работников. — М.: Мир, 1983. — 493 с.
- Химическая энциклопедия / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — 783 с. — ISBN 5-85270-310-9.
- Эйзенберг Д., Кауцман В. Структура и свойства воды. — Л.: Гидрометеоиздат, 1975. — 280 с.
