Кремнийорганические соединения

Кремнийорганические соединения — соединения, в молекулах которых имеется связь между атомами кремния и углерода. Кремнийорганические соединения иногда называют силиконами, от латинского названия кремния «силициум».
Применение[править | править код]
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Кремнийорганические соединения используются для производства смазок, полимеров, резин, каучуков, кремнийорганических жидкостей и эмульсий. Кремнийорганические соединения применяются в косметике, бытовой химии, лакокрасочных материалах, моющих средствах. Отличительной особенностью продукции на основе кремнийорганических соединений от продукции на основе обычных органических соединений являются, как правило, более высокие эксплуатационные качества и характеристики, а также безопасность применения человеком. Кремнийорганические полимеры могут использоваться для изготовления форм в кулинарии. Полимеризация кремнийорганических компаундов и герметиков безопасна для человека и не требует вытяжки.
Классификация[править | править код]
- Производные силанов: (CH3)4Si, CH3SiH2SiH2CH3,(CH3)3SiCl.
- Силазаны (CH3)3SiNHSi(CH3)3
- Силоксаны (CH3)3SiOSi(CH3)3
- Силтианы(CH3)3SiSSi(CH3)3
- Силатраны N(CH2CH2O)3SiR
- Гетероциклические соединения, например диметилсилациклобутан.
- Кремнийорганические полимеры, обычно имеют строение (SiR2O)n
История кремнийорганических соединения[править | править код]
В 1823 году Берцелиус получил чистый кремний действием металлического калия на тетрафторид кремния, что в свою очередь был получен действием фтороводорода на диоксид кремния.
- 4 HF + SiO2 → SiF4 + 2H2 O
- 4 K + SiF4 → 4 KF + Si
В том же году Берцелиус синтезировал первый непосредственный прекурсор кремнийорганических соединений, тетрахлорид кремния (SiCl4).
- Si + 2 Cl2 → SiCl 4
Только через 23 года действием этанола на тетрахлорид кремния было синтезировано первое органическое соединение, содержащее кремний — тетраэтилортосиликат (Si(OEt)4).
- SiCl4 + 4 EtOH → Si (OEt)4 + 4 HCl
Через 17 лет в 1863 году первые кремнийорганические соединения были синтезированы Фриделем и Крафтсом действием алкилцинков на тетрахлорид кремния[1].
- 2 R2Zn + SiCl4 → 2 ZnCl2 + SiR4
Десять последующих лет, применяя очень сложные методы, Фридель и Ладенбург получили ряд новых кремнийорганических соединений действием натрия и этилцинка на тетраэтил ортосиликат: SiEt(OEt)3, SiEt2(OEt)2, SiEt3(OEt), SiEt4 и SiHEt3. В это время были получены также Si2Et6, SiH(OEt)3, а также первые ароматические кремнийорганические соединения, SiPhCl3 и SiPhEt3. В 1885 году Полис реакцией тетрахлоросилана и хлоробензина в присутствии натрия получил тетрафенилсилан, первое кремнийорганическое соединение, которое оставалось твердым при нормальных условиях.
- SiCl4 + 4 PhCl + 4 Na → SiPh4 + 4 NaCl
Из тетрафенилсилана с помощью пентахлорида фосфора были получены трифенилхлоросилан и трифенилсиланол. В 1899 году Киппинг начал исследования с целью синтеза кремнийорганических соединений, имеющих хиральный атом кремния. Очень быстро выяснилось, что существует большая разница между органическими веществами и их кремниевыми аналогами. Поэтому в 1904 году он начал исследования реаций тетрахлорида кремния с реактивами Гриньяра. За тридцать лет были найдены методы синтеза алкилов и арилзамещённых силанов и хлоросиланов, и исследованы их свойства. С помощью гидролиза хлоросиланов были получены силанолы и силандиолы. Попытки расширить количество кремнийорганических соединений, и найти им использование не привели к значительным успехам. В 1939 году Киппинг в своей бейкеривской лекции сделал обзор успехов кремнийорганической химии и пришёл к выводу, что «переспектива близкого и важного развития в этой области органической химии не кажется многообещающей»[2].
Сейчас рассмотрено большинство, если не все известные типы органических производных кремния, и можно увидеть, как мало их по сравнению с полностью органическими; поскольку, кроме того, те немногие соединения, которые известны, очень ограничены в своих реакциях, перспектива какого-либо немедленного и важного прогресса в этом разделе органической химии не кажется обнадеживающей.
Оригинальный текст (англ.)Most if not all of the known types of organic derivatives of silicon have now been considered and it may be seen how few they are in comparison with those which are entirely organic; as moreover the few which are known are very limited in their reactions, the prospect of any immediate and important advance in this section of organic chemistry does not seem to be hopeful.
В 1937 году Андрианов Кузьма Андрианович (1904-1978) советский учёный, специалист в области высокомолекулярной химии, основоположник отечественной кремнийорганической химии, впервые осуществил синтез полиорганосилоксанов. С 1947 года разрабатывает основные принципы синтеза полимеров с неорганическими цепями молекул, в том числе полиорганометаллосилоксанов. Руководил работами по синтезу термостойких кремнийорганических полимеров и материалов на их основе, получивших широкое применение для изоляции электрических машин, аппаратов, производства смазочных веществ, пластических масс, лакокрасочных покрытий и др.В 40-х годах 20-го века началось коммерческое производство кремниевых полимеров, что дало толчок развитию кремнийорганической химии.
Распространение в природе[править | править код]
Считается, что соединения, содержащие связь Si-C, отсутствуют в естественных биохимических процессах. Однако сообщается, что у некоторых видов водорослей эти соединения появляются в виде короткоживущих интермедиатов[3].
2016 Калтеховская группа Фрэнсиса Арнольда методом молекулярной направленной эволюции* создала белок, синтезирующий кремнийорганические соединения в бактериях[4][5].
Соединения кремния с насыщенными связями[править | править код]
В большинстве имеющихся кремнийорганических соединений кремний находится в состоянии sp3-гибридизации, и образует 4 ковалентных связи.
Связи Si-H и Si-галоген[править | править код]
Связь Si-H имеет обратную полярность по отношению к связи CH, то есть атом водорода имеет частичный отрицательный заряд (гидридный характер). Энергия диссоциации связи SiH зависит от соседних атомов, и может изменяться в пределах от 384 кДж/моль для SiH4 до 419 кДж/моль для SiHF3. Связь Si-F является самой прочной из известных ковалентных связей.
Связи Si-C и Si-Si[править | править код]
Связь Si-C длиннее связи C-C (186 нм и 154 нм соответственно) и слабее её (457 кДж/моль и 607кДж/моль соответственно). Благодаря большей электроотрицательности углерода относительно кремния (2.55 и 1.90 соответственно) эта связь имеет определённую полярность. Это придаёт углероду определённый нуклеофильный характера.
Насыщенные связи кремния с другими атомами[править | править код]
Связь Si-O гораздо более стабильной чем связь C-O (809кДж/моль и 538 кДж/моль соответственно[источник не указан 945 дней]).
Соединения кремния с ненасыщенными связями[править | править код]
Одним из важнейших отличий кремния от углерода является трудность синтезирования стабильных соединений с двойными или тройными связями, содержащие кремний. До 1967 года считалось, что вообще невозможно создать кратную связь элемента третьего периода и ниже.
Связи Si=C, Si=Si, Si≡C и Si≡Si[править | править код]
В 1967 году Гусельников и Флауэрс получили неопровержимое подтверждение формирования короткоживущих веществ, силен содержащих двойную связь Si=C[6]. В 1981 году Адриан Брук получил первый стабильный силен, содержащий связь Si=C. В том же году Роберт Вест получил первый стабильный дисилен, содержащий связь Si=Si. Силены и дисилены является термодинамично нестабильными соединениями благодаря низким энергиям п-связей вследствие плохого перекрытия 3p-орбитали кремния и 2p-орбитали углерода и 3p-орбитали кремния соответственно. Поэтому стабилизация кратной связи достигается благодаря использованию громоздких заместителей, (кинетическая стабилизация) или заместителей, содержащих сопряжённые п-системы (термодинамическая стабилизация).
Бета-кремниевый эффект[править | править код]
Силильная группа, находящаяся в бета-положении относительно карбокатиона, стабилизирует его. Это явление называется бета-кремниевым эффектом. Стабилизация достигается через гиперконъюгацию пустой p-орбитали карбокатиона с сигма-орбиталью связи Si-C.

Получение кремнийорганических соединений[править | править код]
Вторым важным прекурсором для кремнийорганических соединений, кроме тетрахлоросилана, упомянутого в историческом обзоре, является трихлоросилан, который получают взаимодействием кремния с соляной кислотой.
- Si + 3 HCl → HSiCl3 + H2
Дихлоросилан может быть получен диспропорционированием трихлоросилана[7]:
- 2 SiHCl 3 ⇔ SiCl4 + SiH2Cl2
Дихлоросилан можно восстановить силаном до монохлоросилана с помощью каталитического процесса:
- SiH2Cl2 + SiH4 → 2 SiH3Cl
Хлоросиланы реагируют со спиртами, образуя алкоксисиланы:
- HSiCl3 + 3MeOH → HSi(MeO)3 + 3HCl
Алкоксисиланы и хлоросиланы реагируют в свою очередь с карбометаличными соединениями (например с реактивами Гриньяра), образуя кремнийорганические соединения:
- HSiCl3 + 3 n-Bu-Li → n-Bu2SiH + 3 LiCl:HSi(MeO)3 + 2 EtMgBr → Et2Si(MeO)H
Другой способ формирования кремнийорганических соединений это понижение кратности двойных и тройных связей углерод-углерод.
- Et3SiH + PhC≡CPh → Et3Si(Ph)C = CH(Ph)
Реакции кремнийорганических соединений и применение в органическом синтезе[править | править код]
Перегруппировка Брука[править | править код]
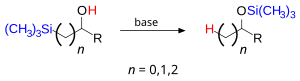
Перегруппировка Брука — миграция кремнийорганической группы, при которой разрывается связь Si-C и образуется связь Si-O. Движущей силой реакции является образование особенно термодинамически стабильной связи Si-O.
Олефинирование по Петерсону[править | править код]
Олефинирование по Петерсону является представителем большого класса реакций олефинирования карбонильных соединений. На первом этапе в результате атаки альфа-кремнийкарба ниона 1 в электрофильном атоме углерода карбонильного соединения формируется аддукт 2 (бета-гидроксисилан). На втором этапе реакции от аддукта элиминирует силанолят R3SiO-, что приводит к формированию алкена[8]. Движущей силой реакции является высокая термодинамическая стабильность связи Si-O, которая формируется на втором этапе реакции.

В зависимости от характера замещения альфа-кремнийкарбониона второй этап реакции может быть спонтанным, или, наоборот, потребовать жестких условий. Привлекательной особенностью реакции Петерсона — зависимость её диастереоселективности от условий, в которых проводится второй этап реакции. Таким образом один диастереомер 2 может в кислотных и щёлочных условиях давать два разных E/Z-изомеров, 3a или 3b.
Реакция Сакураи[править | править код]
Реакция Сакураи (также известная как реакция Хосоми — Сакураи) — органическая реакция между электрофильным атомом углерода (например карбонильной группы) с алилсиланом в присутствии сильной кислоты Льюиса, активирующий электрофил.

Окисления Флеминга — Тамао[править | править код]

Присоединение гидросилана[править | править код]
Реакция присоединения связи Si-H в связи C = C или связи C≡C, катализируемой комплексами переходных металлов, например H 2 PtCl 6.
Общий механизм отражён на рисунке. Присоединение происходит обычно против правила Марковникова[9].

Защитные группы[править | править код]
Кремниевые эфиры широко используются как защитные группы для алкоголей. Защита обычно происходит реакцией алкоголя с силанхлоридом в щёлочной среде. Устойчивость защитной группы к кислотной или щёлочной среде зависит от алкильных заместителей на атоме кремния. Относительное сопротивление силанных групп в кислой среде:
- TMS (1) <TES (64) <TBS (20000) <TIPS (700000) <TBDPS (5000000)
Относительное сопротивление силанных групп в щёлочной среде:
- TMS (1) <TES (10-100) <TBS ~ TBDPS (20000) <TIPS (100000)
Снятие защиты происходит обычно с помощью агентов, содержащих фтор, например фтороводорода или TBAF.
Силанные еноляты и реакция Мукайамы[править | править код]


Примечания[править | править код]
- ↑ Robert West and Thomas J. Barton J. Chem. Educ., 1980, 57 (3), p 165, doi:10.1021/ed057p165
- ↑ F.S. Kipping Proc. R. Soc. Lond. A 1937 159, doi:10.1098/rspa.1937.0063
- ↑ Stephen D. Kinrade, Ashley-M. E. Gillson and Christopher T. G. Knight (2002), Silicon-29 NMR evidence of a transient hexavalent silicon complex in the diatom Navicula pelliculosa. J. Chem. Soc., Dalton Trans., 307—309, doi:10.1039/b105379p
- ↑ Kan, S. B. Jennifer (November 25, 2016). "Directed evolution of cytochrome c for carbon–silicon bond formation: Bringing silicon to life". Science. 354 (6315): 1048—1051. doi:10.1126/science.aah6219. Архивировано из оригинала 24 ноября 2016. Дата обращения: 25 ноября 2016.
- ↑ Castelvecchi, Davide (November 24, 2016). "Living cells bind silicon and carbon for the first time". Nature. doi:10.1038/nature.2016.21037. Архивировано из оригинала 25 ноября 2016. Дата обращения: 25 ноября 2016.
- ↑ The thermal decomposition of 1,1-dimethyl-1-silacyclobutane and some reactions of an unstable intermediate containing a silicon-carbon double bond L. E. Gusel’Nikov and M. C. Flowers Chem. Commun. (London), 1967, 864—865, doi:10.1039/C19670000864
- ↑ Vorotyntsev, V., Mochalov, G., Kolotilova, M., Kinetics of Dichlorosilane Separation from a Mixture of Chlorosilanes by Distillation Using a Regular Packing, Theoretical Foundations of Chemical Engineering, 38(4), 355—359
- ↑ van Staden, L. F.; Gravestock, D.; Ager, D. (2002), J. Chem. Soc. Rev. 2002, 31, 195—200 doi:10.1039/A908402I
- ↑ «Hydrosilylation A Comprehensive Review on Recent Advances» B. Marciniec (ed.), Advances in Silicon Science, Springer Science, 2009. doi:10.1007/978-1-4020-8172-9
Для улучшения этой статьи желательно:
|
