Ставудин
| Ставудин | |
|---|---|
 | |
 | |
| Химическое соединение | |
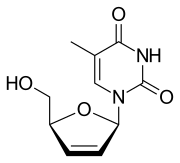
| ИЮПАК | 1-[(2R,5S)-5-(гидроксиметил)-2,5-дигидрофуран-2-ил]-5-метил-1,2,3,4-тетрагидропиримидин-2,4-дион |
| Брутто-формула | C10H12N2O4 |
| Молярная масса | 224.213 г/моль |
| CAS | 3056-17-5 |
| PubChem | 18283 |
| DrugBank | DB00649 |
| Состав | |
| Классификация | |
| АТХ | J05AF04 |
| Фармакокинетика | |
| Биодоступн. | 86.4% |
| Связывание с белками плазмы | незначительное |
| Метаболизм | Незначительный |
| Период полувывед. | 1.44 – 2.28 ч |
| Экскреция | С мочой (95%), калом (3%) |
| Лекарственные формы | |
| капсулы (30 мг, 40 мг) | |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Ставудин, Стаг | |
Ставудин (2',3'-дидегидро-2',3'-дидеокситимидин, d4t, фирменное наименование Zerit) — антиретровирусный препарат, используемый для профилактики и лечения ВИЧ/СПИДа[1].
Всемирной организацией здравоохранения включён в перечень основных лекарственных средств[2].
Правительством Российской Федерации Ставудин включён[3] в перечень Жизненно необходимых и важнейших лекарственных препаратов.
Нежелательные явления[править | править код]
Основной тяжёлый побочный эффект препарата — периферическая невропатия, которая может быть откорректирована путём снижения дозировки. Ставудин в лабораторных тестах показал генотоксический эффект, но в клинических дозах канцерогенные эффекты отсутствуют. Он также является одним из наиболее вероятных противовирусных препаратов, который вызывает липодистрофию, и по этой причине Ставудин перестал считаться подходящим лечением для большинства пациентов в развитых странах.
В Таиланде используется HLA-B*4001 в качестве генетического маркера для предсказания, у каких пациентов будет развиваться ставудин-ассоциированная липодистрофия, чтобы избежать или сократить применение ставудина[4].
Препарат до сих пор используется в первой линии терапии в условиях ограниченных ресурсов, например, в Индии. Только в случае развития периферической нейропатии или в случае наступления беременности ставудин там заменяют на зидовудин.
30 ноября 2009 года Всемирная организация здравоохранения заявила, что «[ВОЗ] рекомендует странам прекратить использование Ставудина, или d4t, из-за его долгосрочных необратимых побочных эффектов. Ставудин до сих пор широко используется в терапии первой линии в развивающихся странах из-за его низкой стоимости и широкой доступности. Зидовудин (azt) или тенофовир (tdf с) рекомендуются как менее токсичные и не менее эффективные альтернативы»[5].
Механизм действия[править | править код]
Ставудин представляет собой аналог тимидина. Он фосфорилируется под действием клеточных киназ в активный трифосфат. Ставудина трифосфат ингибирует обратную транскриптазу ВИЧ, конкурируя с естественным субстратом, тимидин трифосфатом. Это приводит к прекращению репликации ДНК.
Одновременное применение зидовудина не рекомендуется, так как это может тормозить внутриклеточное фосфорилирование ставудина. Другие анти-ВИЧ препараты не обладают этим свойством.
Фармакокинетика[править | править код]
Быстро и полностью всасывается при приёме внутрь. Максимальная концентрация достигается через 1 час. Не кумулирует. Незначительная часть связывается с белками плазмы, около половины — с форменными элементами. Период полувыведения составляет 1,7-3,5 ч. Более 30 % выводится почками в неизменённом виде, при тяжёлом нарушении их функции период полувыведения удлиняется до 8 часов. В течение суток с мочой выводится 40 %[6].
История[править | править код]
Ставудин был впервые синтезирован в 1960-е годы Джеромом Хорвицем[7][8]. Впоследствии препарат был пересмотрен в качестве анти-ВИЧ агента в Бельгии. Ставудин был разработан доктором Уильямом Прусоффом (William Prusoff) и доктором Тай-Сюн Лин (Tai-Shun Lin), получил одобрение от FDA 24 июня 1994 для взрослых и 6 сентября 1996 года для использования в педиатрии. Дополнительное одобрение получено в 2001 году. Ставудин это четвёртый антиретровирусный препарат на рынке, его патент истёк в Соединённых Штатах 25 июня 2008 года.
Примечания[править | править код]
- ↑ Stavudine. The American Society of Health-System Pharmacists. Дата обращения: 31 июля 2015. Архивировано 3 марта 2016 года.
- ↑ WHO Model List of EssentialMedicines. World Health Organization (октябрь 2013). Дата обращения: 22 апреля 2014. Архивировано 23 апреля 2014 года.
- ↑ Распоряжение Правительства Российской Федерации от 26.12.2015 № 2724-р. Государственная система правовой информации. Дата обращения: 30 января 2016. Архивировано 6 февраля 2016 года.
- ↑ Wangsomboonsiri W., Mahasirimongkol S., Chantarangsu S., etal. Association between HLA-B*4001 and lipodystrophy among HIV-infected patients from Thailand who received a stavudine-containing antiretroviral regimen (англ.) // Clinical Infectious Diseases : journal. — 2010. — 15 February (vol. 50, no. 4). — P. 597—604. — doi:10.1086/650003. — PMID 20073992.
- ↑ New HIV recommendations to improve health, reduce infections and save lives. World Health Organization (30 ноября 2009). Дата обращения: 30 января 2016. Архивировано 18 января 2010 года.
- ↑ Ставудин. Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Инструкция, применение и формула.
- ↑ J. P. Horwitz, J Chua, M DaRooge et al. Nucleosides. IX. The formation of 2′,3′-unsaturated pyrimidine nucleosides via a novel β-elimination reaction (англ.) // Journal of Organic Chemistry : journal. — 1966. — Vol. 31. — P. 205. — doi:10.1021/jo01339a045. — PMID 590081.
- ↑ Oral account of the history of AZT, d4T and ddC by Jerome Horwitz and Hiroaki Mitsuya in the documentary film I am alive today — History of an AIDS drug Архивная копия от 3 марта 2016 на Wayback Machine.
См. также[править | править код]
Ссылки[править | править код]
- Federally approved HIV/AIDS medical practice guidelines. (англ.). A service of the U.S. Department of Health and Human Services (HHS). Дата обращения: 30 января 2016.