Окислительное декарбоксилирование пирувата
Окисли́тельное декарбоксили́рование пирува́та — биохимический процесс, заключающийся в отщеплении одной молекулы углекислого газа (СО2) от молекулы пирувата и присоединении к декарбоксилированному пирувату кофермента А (КоА) с образованием ацетил-КоА; является промежуточным этапом между гликолизом и циклом трикарбоновых кислот. Декарбоксилирование пирувата осуществляет сложный пируватдегидрогеназный комплекс (ПДК), включающий в себя 3 фермента и 2 вспомогательных белка, а для его функционирования необходимы 5 кофакторов (КоА, НАД+, тиаминпирофосфат (ТПФ), ФАД и липоевая кислота (липоат)). Суммарное уравнение окислительного декарбоксилирования пирувата таково[1]:

У эукариот пируватдегидрогеназный комплекс локализован в митохондриях, у бактерий — в цитозоле. Образующийся в результате ацетил-КоА далее вовлекается в цикл Кребса[1].
Окислительное декарбоксилирование пирувата — необратимый процесс. Образующийся в ходе этого процесса НАДН впоследствии отдаёт гидридный ион (Н-) в дыхательную цепь, в которой при аэробном дыхании конечным акцептором электронов является кислород, а при анаэробном — другие окисленные соединения (например, сульфат, нитрат). Перенос электронов с НАДН на кислород даёт 2,5 молекулы АТФ на пару электронов. Необратимость реакции, осуществляемой пируватдегидрогеназным комплексом, была показана в исследованиях с применением радиоактивных изотопов: комплекс не может обратно присоединить меченый СО2 к ацетил-КоА с образованием пирувата[2].
Помимо окислительного, существует неокислительное декарбоксилирование пирувата до ацетальдегида (и далее до этанола) и СО2. Этот процесс осуществляется ферментом пируватдекарбоксилазой, к нему способны многие растения, дрожжи и некоторые бактерии[3].
Коферменты[править | править код]
Комбинированное дегидрирование и декарбоксилирование пирувата до ацильной группы, которая в дальнейшем войдёт в ацетил-КоА, осуществляется тремя различными ферментами, для функционирования которых необходимы 5 различных коферментов или простетических групп: тиаминпирофосфат (ТПФ), ФАД, кофермент А (КоА), НАД и липоат. Четыре из них являются производными витаминов: тиамина, или витамина В1 (ТПФ), рибофлавина, или витамина В2 (ФАД), ниацина, или витамина РР (НАД) и пантотеновой кислоты, или витамин В5 (КоА)[4].
ФАД и НАД являются переносчиками электронов, а ТПФ известен также как кофермент пируватдекарбоксилазы, участвующей в брожении[4].
Кофермент А имеет активную тиольную группу (—SH), которая имеет критическое значение для функционирования КоА в качестве переносчика ацильной группы в ряде метаболических реакций. Ацильные группы при этом ковалентно связываются с тиольной группой, образуя тиоэфиры. Из-за их относительно высокой стандартной свободной энергии гидролиза тиоэфиры обладают высокой способностью к переносу ацильных групп к различным молекулам-акцепторам. Поэтому ацетил-КоА иногда также называют «активированной уксусной кислотой»[4][5].
Пятый кофактор пируватдегидрогеназного комплекса, остаток липоевой кислоты — липоат, имеет две тиольные группы, которые могут подвергаться обратимому окислению с образованием дисульфидной связи (—S—S—), подобно тому, как это происходит между двумя остатками аминокислоты цистеина в белке. Из-за своей способности подвергаться окислению и восстановлению липоат может служить в качестве переносчика как электронов (или H+), так и ацильных групп[4].
Пируватдегидрогеназный комплекс[править | править код]
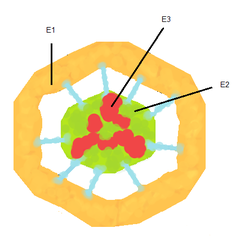
Пируватдегидрогеназный комплекс (ПДК)
Пируватдегидрогеназный комплекс (ПДК) включает 3 фермента: пируватдегидрогеназу (Е1), дигидролипоилтрансацетилазу (Е2) и дигидролипоилдегидрогеназу (Е3). Каждый из этих ферментов присутствует в комплексе во множестве копий. Количество копий каждого фермента, а следовательно, и размер комплекса варьирует среди различных видов.
Комплекс ПДК млекопитающих достигает около 50 нм в диаметре, что более чем в 5 раз превышает диаметр целой рибосомы; эти комплексы достаточно велики, чтобы быть различимыми в электронный микроскоп. В ПДК коровы входят 60 идентичных копий Е2, которые формируют пентагональный додекаэдр (коровая часть комплекса) диаметром около 25 нм.
В кор ПДК у бактерии Escherichia coli входит 24 копии Е2. К Е2 присоединяется простетическая группа липоат (остаток альфа-липоевой кислоты) с аминокислотой лизином, которая связывается амидной связью с ε-аминогруппе остатка лизина, входящего в состав Е2. Е2 состоит из трёх функционально различных доменов: аминотерминального липоильного домена, содержащего остаток лизина, связывающийся с липоатом; центрального Е1- и Е3-связывающего домена; внутреннего корового ацилтрансферазного домена, содержащего активные центры ацилтрансферазы. У дрожжей в ПДК имеется единственный липоильный домен, у млекопитающих — два, а у E. coli — три. Домены Е2 связываются линкерными последовательностями, состоящими из 20—30 аминокислотных остатков, причём в них остатки аланина и пролина перемежаются с заряженными аминокислотыми остатками[6].
С активным центром Е1 связывается ТПФ, а с активным центром Е3 — ФАД. Также в состав комплекса ПДК входят два регуляторных белка — протеинкиназа и фосфопротеинфосфатаза. Такая основная структура из Е1-Е2-Е3 оставалась консервативной в ходе эволюции. Комплексы такого устройства принимают участие и в других реакциях, например, окислении α-кетоглутарата в ходе цикла Кребса и окислении α-кетокислот, образующихся при катаболической утилизации разветвлённых аминокислот: валина, изолейцина, лейцина. У изученных видов Е3 ПДК идентичен Е3 двух вышеупомянутых комплексов. Примечательное сходство структур белков, кофакторов и механизмов реакций, осуществляемых этими комплексами, свидетельствует об общности их происхождения[1]. При прикреплении липоата к лизину Е2 образуется длинная, гибкая «рука», которая может перемещаться с активного центра Е1 в активные центры Е2 и Е3, то есть на расстояния предположительно 5 нм и более[7].
Механизм[править | править код]
Окислительное декарбоксилирование пирувата включает несколько стадий:
- Стадия 1 идентична пируватдекарбоксилазной реакции. Первый атом углерода (С-1) пирувата уходит в виде СО2, а С-2, в пирувате находящийся в альдегидной форме, прикрепляется к ТПФ в виде гидроксиэтильной группы (—СНОН—СН3). Первая стадия является наиболее медленной и поэтому ограничивает скорость всего процесса. Кроме того, на этом этапе комплекс ПДК проявляет свою субстратную специфичность. Эта реакция осуществляется пируватдегидрогеназой (Е1).
- Стадия 2. Гидроксиэтильная группа окисляется до карбоновой кислоты (ацетата). Два электрона, освобождаемых при этой реакции, идут на восстановление связи —S—S— липоильной группы Е2 до двух тиольных (—SH) групп.
- Стадия 3. Ацетильный остаток, образующийся в ходе окислительно-восстановительной реакции на стадии 2, сначала связывается тиоэфирной связью с липоильной —SH-группой, а затем переносится на КоА с образованием ацетил-КоА. Таким образом, энергия окисления идёт на образование высокоэнергетического тиоэфира ацетата. Стадии 2 и 3 катализируются дигидролипоилтрансацетилазой (Е2).
- Стадия 4 и стадия 5 катализируются дигидролипоилдегидрогеназой (Е3). В ходе этих двух последних реакций восстановленный липоиллизин снова возвращается в окисленную форму, который в дальнейшем может участвовать в следующем цикле окислительного декарбоксилирования пирувата. Электроны, изначально принадлежавшие гидроксиэтильной группе, при этом переносятся с липоиллизина сначала на ФАД с образованием ФАДH2, а потом на НАД+ с образованием НАДН + H+[8].

Центральную роль в реакции, осуществляемой комплексом ПДК, играют липоиллизиновые «руки» Е2, способные «раскачиваться» и забирать два электрона от Е1, а также ацетильную группу, образовавшуюся из пирувата, и доставлять электроны к Е3. Все эти ферменты и коферменты собраны в комплекс, благодаря чему промежуточные соединения могут вступать в необходимые реакции быстро и не диффундируя с поверхности ферментного комплекса. За счёт этого промежуточные соединения не покидают комплекса, и поддерживается очень высокая локальная концентрация субстрата Е2. Это также предотвращает перехватывание активированной ацетильной группы другими ферментами, использующими её в качестве субстрата[8].
Органические соединения, содержащие мышьяк, являются ингибиторами ПДК, поскольку взаимодействуют с восстановленными в ходе окислительного декарбоксилирования пирувата тиольными группами липоильной группы Е2 и блокируют их нормальную работу[9].
Регуляция[править | править код]
У млекопитающих ПДК сильно подавляется АТФ, а также продуктами реакции: ацетил-КоА и НАДН. Аллостерическое подавление окисления пирувата значительно усиливается в присутствии длинноцепочечных жирных кислот. АМФ, КоА и НАД+, накапливающиеся тогда, когда в цикл Кребса поступает слишком мало ацетата, аллостерически активируют комплекс ПДК. Таким образом, ферментный комплекс подавляется, когда имеется достаточно ацетил-КоА или сырья (жирные кислоты) для осуществления альтернативных путей образования ацетил-КоА, а отношения [АТФ]/[АДФ] и [НАДН]/[НАД+] достаточно велики. Напротив, при большой потребности в энергии и необходимости большего количества ацетил-КоА для функционирования цикла Кребса ПДК активируется[10].
У млекопитающих к этим аллостерическим механизмам добавляется второй уровень регуляции: ковалентная модификация белка. Комплекс ПДК подавляется обратимым фосфорилированием по специфическим остаткам серина на одной из двух субъединиц E1. Ранее отмечалось, что, помимо субъединиц E1, E2 и E3 у млекопитающих в комплекс ПДК входят два регуляторных белка, единственным назначением которых является регуляция активности комплекса. Специфичная протеинкиназа фосфорилирует и тем самым инактивирует E1, а специфичная фосфопротеинфосфатаза удаляет фосфатные группы путём гидролиза и тем самым активирует E1. Киназа аллостерически активируется АТФ: когда концентрация АТФ велика (что свидетельствует о достаточном количестве энергии в клетке), комплекс ПДК инактивируется фосфорилированием E1. Когда [АТФ] понижена, активность киназы снижается, и фосфатаза убирает фосфатные группы с E1, активируя комплекс[11].
Комплекс ПДК растений, располагающийся в матриксе митохондрий и пластидах, подавляется продуктами его активности — НАДН и ацетил-КоА. Растительный митохондриальный фермент также регулируется обратимым фосфорилированием: пируват подавляет киназу, активируя ПДК, а NH4+ стимулирует киназу и инактивирует комплекс. У E. coli ПДК регулируется аллостерически по схожему с млекопитающими механизму, однако, по-видимому, не регулируется фосфорилированием[11].
Клиническое значение[править | править код]
Четыре витамина (тиамин, рибофлавин, ниацин, пантотеновая кислота), из которых образуются коферменты ПДК, обязательно должны присутствовать в рационе человека[4]. Кроме того, мутации генов, кодирующих субъединицы ПДК, а также недостаток тиамина в пище могут иметь очень серьёзные последствия. Животные, испытывающие недостаток тиамина, не могут нормально окислять пируват. Особенно это важно для мозга, который обычно получает энергию при аэробном окислении глюкозы, а этот процесс обязательно включает окисление пирувата.
Бери-бери — заболевание, развивающееся при недостатке тиамина — характеризуется расстройством функций нервной системы. Эта болезнь обычно встречается в популяциях людей, чей рацион состоит в основном из белого (очищенного) риса, лишённого шелухи, в которой содержится большая часть тиамина риса. Недостаточность тиамина может также развиться у людей, постоянно употребляющих алкоголь, так как большая часть получаемой ими энергии приходится на «пустые калории» очищенного спирта, лишённого витаминов. Повышенное содержание пирувата в крови часто является индикатором нарушений в окислении пирувата из-за одной из вышеперечисленных причин[12].
Другие пути преобразования пирувата[править | править код]
У некоторых микроорганизмов преобразование пирувата в ацетил-КоА (или другие продукты) может осуществляться и другими способами, помимо вышеописанного (комплекс ПДК используется аэробами). Такими преобразованиями могут быть:
- пируват + КоА + ФАД → ацетил-КоА + ФАДH2 + СО2. Реакция катализируется пируват:ферредоксин оксиредуктазой, характерна для анаэробов, в частности, клостридий. Из ФАДH2 далее при участии гидрогеназы образуется молекулярный водород.
- пируват + КоА → ацетил-КоА + формиат. Фермент — пируватформиатлиаза, реакция характерна для Enterobacteriaceae, фотобактерий и некоторых фототрофов.
- пируват → ацетальдегид + СО2. Фермент — пируватдекарбоксилаза, реакция характерна для дрожжей[13].
Примечания[править | править код]
- ↑ 1 2 3 Nelson, Cox, 2008, p. 616.
- ↑ Nelson, Cox, 2008, p. 616—617.
- ↑ van Zyl L. J., Schubert W. D., Tuffin M. I., Cowan D. A. Structure and functional characterization of pyruvate decarboxylase from Gluconacetobacter diazotrophicus. (англ.) // BMC structural biology. — 2014. — Vol. 14, no. 1. — P. 21. — doi:10.1186/s12900-014-0021-1. — PMID 25369873.
- ↑ 1 2 3 4 5 Nelson, Cox, 2008, p. 617.
- ↑ Нетрусов, Котова, 2012, с. 123.
- ↑ Nelson, Cox, 2008, p. 618.
- ↑ Nelson, Cox, 2008, p. 618—619.
- ↑ 1 2 Nelson, Cox, 2008, p. 619.
- ↑ Pyruvate Dehydrogenase & Krebs Cycle. Дата обращения: 3 января 2015. Архивировано из оригинала 11 февраля 2015 года.
- ↑ Nelson, Cox, 2008, p. 635—636.
- ↑ 1 2 Nelson, Cox, 2008, p. 636.
- ↑ Nelson, Cox, 2008, p. 620.
- ↑ Нетрусов, Котова, 2012, с. 123, 128.
Литература[править | править код]
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells.. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |