Борная кислота
| Борная кислота | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
Ортоборная кислота | ||
| Хим. формула | H3BO3 | ||
| Рац. формула | B(OH)3 | ||
| Физические свойства | |||
| Состояние | Твёрдое | ||
| Молярная масса | 61,83 г/моль | ||
| Плотность | 1,435 (+15 °C) г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 170,9 °C, 444 K, 340 °F | ||
| • кипения | (573 K, 572 °F) 300 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,24 (I), 12,74 (II), 13,80 (III) | ||
| Растворимость | |||
| • в воде |
2,52 (0 °C) г/100 мл |
||
| Классификация | |||
| Рег. номер CAS | 10043-35-3 | ||
| PubChem | 7628 | ||
| Рег. номер EINECS | 233-139-2 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E284 | ||
| RTECS | ED4550000 | ||
| ChEBI | 33118 | ||
| ChemSpider | 7346 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
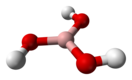
Бо́рная кислота́ (от лат. acidum Boricum, ортоборная кислота, химическая формула — H3BO3 или B(OH)3) — слабая химическая неорганическая кислота, отвечающая высшей степени окисления бора (+3). Впервые была получена в 1702 году[1] в Париже немецким химиком Вильгельмом Хомбергом (состава ее он, однако, не знал).
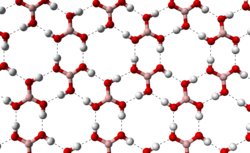
При стандартных условиях, борная кислота — это бесцветное кристаллическое вещество в виде чешуек без запаха, имеет слоистую триклинную решётку, в которой молекулы кислоты соединены водородными связями в плоские слои, слои соединены между собой межмолекулярными связями, длина которых составляет 272 пм.
Метаборная кислота (HBO2) — это бесцветные кристаллы. Она существует в трёх модификациях — наиболее устойчивой γ-НВО2 с кубической решёткой, β-НВО2 с моноклинной решёткой и α-НВО2 с ромбической решёткой.
Нахождение в природе[править | править код]
В природе свободная борная кислота встречается в виде минерала сассолина, в горячих источниках и минеральных водах.
Физические свойства[править | править код]
Борная кислота — это одноосновная кислота Льюиса, часто используемая в качестве инсектицида, антисептика, огнезащитного состава, поглотителя нейтронов или предшественника для получения иных химических составов.
При нагревании ортоборная кислота теряет воду и сначала переходит в метаборную кислоту, затем в тетраборную H2B4O7. При дальнейшем нагревании обезвоживается до борного ангидрида.
Водные растворы борной кислоты являются смесью полиборных кислот общей формулы Н3m-2nВmО3m-n. В природе встречается в виде минерала сассолина.
Расстояние между соседними слоями — 318 пм.
Химические свойства[править | править код]
Борная кислота проявляет очень слабые кислотные свойства. Она сравнительно мало растворима в воде. Её кислотные свойства обусловлены не отщеплением катиона Н+, а присоединением гидроксильного аниона:
- Ka = 5,8⋅10−10 моль/л; pKa = 9,24.
Она легко вытесняется из растворов своих солей большинством других кислот. Соли её, называемые боратами, производятся обычно от различных полиборных кислот, чаще всего — тетраборной Н2В4О7, которая является значительно более сильной кислотой, чем ортоборная.
Очень слабые признаки амфотерности B(OH)3 проявляет, образуя малоустойчивый гидросульфат бора В(HSO4)3.
При нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3−, поскольку ортобораты гидролизуются практически полностью, вследствие слишком малой константы образования [В(ОН)4]−. В растворе образуются тетрабораты, метабораты или соли других полиборных кислот:
- Избытком щелочи они могут быть переведены в метабораты:
Мета- и тетрабораты гидролизуются, но в меньшей степени (реакции, обратные приведённым).
В подкисленных водных растворах боратов устанавливаются следующие равновесия:
При нагревании борная кислота растворяет оксиды металлов, образуя соли:
При избытке оксида образуется метаборат кальция:
При недостатке оксида образуется тетраборат кальция:
Взаимодействует с металлами при нагревании:
Термическое разложение борной кислоты происходит в две стадии при медленном нагревании:
Со спиртами в присутствии концентрированной серной кислоты образует эфиры:
- Кислота в данном случае отыгрывает роль водоотбирающего средства, и дополнительно протонирует ортоборатную кислоту для разрушения связей между бором и кислородом.
Образование борнометилового эфира В(ОСН3)3 является качественной реакцией на Н3ВО3 и соли борных кислот, при поджигании борнометиловый эфир горит красивым ярко-зелёным пламенем.
Получение[править | править код]
Борная кислота может быть получена путём смешения буры (тетрабората натрия) с минеральной кислотой, например, соляной:
Является продуктом гидролиза диборана или тригалогенидов бора[2]:
Борная кислота в медицине[править | править код]
Борный спирт (от лат. Solutio Acidi borici spirituosa) — раствор борной кислоты в этиловом спирте (как правило, в 70 % этаноле).
Спиртовые растворы борной кислоты в концентрации 0,5 %, 1 %, 2 %, 3 %, 5 % готовятся на 70 % этиловом спирте и применяются в качестве антисептика и как противозудное средство при обтирании здоровых участков кожи вокруг очагов пиодермии, а также в качестве ушных капель.
Борная кислота может быть опасна только при бесконтрольном приёме внутрь. Опасная концентрация в организме человека (а особенно ребёнка) может возникнуть при регулярном применении. Смертельная доза при отравлении пероральным приёмом для взрослого человека составляет 15-20 г, для детей — 4-5 г [3].
Борная кислота применяется в медицине с 1860-х годов как антисептическое средство, не раздражающее ран и не имеющее вкуса, запаха и цвета. В современной медицине противомикробная эффективность борной кислоты считается низкой.
Использование борной кислоты в качестве антисептического средства для детей, а также беременных и кормящих женщин было запрещено 2 февраля 1987 года Министерством здравоохранения СССР по рекомендации Фармакологического комитета с формулировкой: «…запретить использование борной кислоты в качестве антисептического средства у детей грудного возраста, а также у женщин в период беременности и лактации в связи с её низкой активностью и высокой токсичностью»[4].
Применение[править | править код]
- В ядерных реакторах в качестве поглотителя нейтронов, растворённого в теплоносителе ядерного реактора.
- Борное удобрение.
- В лабораториях для приготовления буферных растворов.
- В медицине — как самостоятельное дезинфицирующее средство для взрослых, а также в виде 2%-го раствора — для промывки кожи после попадания щелочей.
- На основе борной кислоты производятся различные комбинированные препараты (группа АТХ D08AD), например паста Теймурова.
- В пленочной фотографии — в составе мелкозернистых проявителей и кислых фиксажей для создания слабой кислотной среды.
- В пищевой промышленности зарегистрирована как пищевая добавка E284 (на территории России эта добавка не входит в список разрешённых к применению[5]).
- В ювелирном деле — как основа флюсов для пайки золотосодержащих сплавов.
- В литейном производстве — связующее при кислой футеровке печей, компонент защиты струи от окисления при разливке магниевых сплавов.
- В быту — уничтожение тараканов, муравьёв, клопов.
- В производстве керамики, оптоволокна, стекловолокна, стекла[6],
- В качестве антипирена для защиты древесины,
- В составе электролитов для меднения и никелирования.
- Как люминофор или в качестве компонента люминофора для учебных экспериментов по люминесценции веществ.[7][8][9]
Примечания[править | править код]
- ↑ Борная кислота: сайт о веществе и его применении. Дата обращения: 6 декабря 2022. Архивировано 6 декабря 2022 года.
- ↑ Housecroft, C. E.; Sharpe, A. G. Chapter 13: The Group 13 Elements // Inorganic Chemistry (англ.). — 3rd. — Pearson, 2008. — P. 340. — ISBN 978-0-13-175553-6.
- ↑ Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / под ред. проф. Н. Ф. Лазарева. — Л.: Химия, 1977. — Т. 3. — С. 310. — 608 с.
- ↑ Прозоровский В. Коварная борная кислота // Наука и жизнь : журнал. — М., 2003. — Ноябрь (№ 11). — ISSN 0028-1263. Архивировано 14 января 2018 года.
- ↑ СанПиН 2.3.2.1293-03. Дата обращения: 23 декабря 2014. Архивировано 4 марта 2016 года.
- ↑ Применение борной кислоты. Дата обращения: 7 июля 2016. Архивировано 22 июля 2016 года.
- ↑ Исследовательская работа учащихся по химии. Твердофазный синтез люминофоров на основе борной кислоты. Дата обращения: 17 сентября 2019. Архивировано 28 марта 2022 года.
- ↑ Способы исследования люминофоров на базе школьного кабинета физики
- ↑ В. Н. Витер. Люминофоры на основе борной кислоты. Boric acid phosphors. (How to prepare variety luminophores from boric acid and organic compounds) // «Химия и химики» : электронный журнал. — К.: В. Н. Витер, 2017. — № 1. Архивировано 28 сентября 2019 года.
Литература[править | править код]
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: «Химия», 1994
- Реми Г. «Курс неорганической химии» М.: «Иностранная литература», 1963
- М. Д. Машковский. Лекарственные средства. — М.: ООО «Новая волна», 2002. — Т. 2. — 608 с. — 25 000 экз. — ISBN 5-7864-0129-4.



![{\mathsf {B(OH)_{3}+H_{2}O\rightarrow H[B(OH)_{4}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/64acca2a47da715749d1c5a357572c40db89e92f)


![{\mathsf {3H[B(OH)_{4}]\rightleftarrows H^{+}+[B_{3}O_{3}(OH)_{4}]^{-}+5H_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f133f564e3cc3ee790fcc4bd357d169dd359ea94)
![{\mathsf {[B_{3}O_{3}(OH)_{4}]^{-}+OH^{-}\rightleftarrows [B_{3}O_{3}(OH)_{5}]^{{2-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/602de5e5f6911e06bb8986fb8cf34a96185c4e61)



![{\displaystyle {\mathsf {H_{3}BO_{3}{\xrightarrow[{}]{107,5^{o}C}}HBO_{2}+\ H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/576fbf0b98e49d69ca0d286cc5502592f1e6c392)
![{\displaystyle {\mathsf {2HBO_{2}{\xrightarrow[{}]{150^{o}C}}B_{2}O_{3}+\ H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3841155d4f3b212db68d7400f91273e228289e5c)



