Изопрен
Изопрен[1]
| |
|---|---|
Общие
| |
| Систематическое наименование | 2-метилбутадиен-1,3
|
| Традиционные названия | изопрен |
| Хим. формула | C₅H₈ |
| Рац. формула | C5H8 |
Физические свойства
| |
| Плотность | 0,681 г/см³ |
| Поверхностное натяжение | 18,22 мН/м |
| Динамическая вязкость | 0,216 мПа·с |
Термические свойства
| |
| Т. плав. | −145,95 ℃ |
| Т. кип. | 34,059 ℃ |
| Т. всп. | −54 ℃ |
| Т. свспл. | 220 ℃ |
| Пр. взрыв. | 1—9,7 % |
| Кр. темп. | 483,3 К |
| Кр. давл. | 3,74 МПа |
| Кр. плотн. | 0,247 г/см3 |
| Мол. теплоёмк. | 102,69 Дж/ (моль·К) (г), 151,07 Дж/(моль·К) (ж) |
| Энтальпия образования | −75,75 кДж/моль (г), −49,36 кДж/моль (ж) |
| Энтальпия плавления | 4,83 кДж/моль |
| Энтальпия кипения | 26,3 |
| Удельная теплота испарения | 26,39 кДж/моль |
| Давление пара | 60,7 кПа |
Химические свойства
| |
| Растворимость в воде | 0,38 г/л (20 °C) |
Оптические свойства
| |
| Показатель преломления | 1,42194 |
Классификация
| |
| Номер CAS | 78-79-5 |
| PubChem | 6557 |
| ChemSpider | 6309 |
| Номер EINECS | 201-143-3 |
| ChEBI | 35194 |
| Номер ООН | 1218 |
CC(=C)C=C
| |
InChI=1S/C5H8/c1-4-5(2)3/h4H,1-2H2,3H3
| |
Безопасность
| |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Изопре́н (2-метилбутадиен-1,3) — ненасыщенный углеводород, принадлежащий к диеновому ряду, представляющий собой бесцветную летучую жидкость с характерным запахом. Является мономером натурального каучука, остаток его молекулы входит во множество других природных соединений — изопреноидов, терпеноидов и т. д.
Изопрен растворим во многих органических растворителях, например, с этиловым спиртом он смешивается в произвольном соотношении. Плохо растворим в воде. При полимеризации образует изопреновые каучуки и гуттаперчи. Изопрен также вступает в различные реакции сополимеризации.
Основное применение в промышленности — синтез изопреновых каучуков, некоторых медицинских препаратов, душистых веществ.
Получение изопрена[править | править код]
Устаревшие методы[править | править код]
Изопрен был впервые получен английским химиком Чарльзом Уильямсом в 1860 году путём пиролиза натурального каучука и он же указал его верную эмпирическую химическую формулу C5H8[2][3] и дал веществу название без какого-либо объяснения значения[3][4].
Наиболее распространённым способом получения изопрена в лабораторных условиях было термическое разложение скипидарного масла в так называемой изопреновой лампе — специальном приборе с нагреваемой электрическим током спиралью. Во время Второй мировой войны в США изопрен получали пиролизом лимонена в промышленных масштабах. До окончания войны изопрен был слишком дорог для производства синтетического каучука, однако ситуация изменилась с появлением методов его получения из нефти, а также с развитием технологии его полимеризации[5].
Синтетические методы[править | править код]
Промышленные методы получения изопрена могут быть разделены на группы в зависимости от исходных реагентов для сборки пятиуглеродного скелета молекулы:
- ;
- ;
- ;
- .

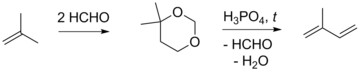
Основным блоком C4 для синтеза изопрена является изобутилен, к которому в кислой среде (серная кислота или ионообменные смолы) присоединяют формальдегид с образованием 4,4-диметил-1,3-диоксана с выходом 74—80 % (реакция Принса), который далее разлагают при нагревании (200—300 °C) в присутствии ортофосфорной кислоты, что даёт изопрен с выходом 43—46 %. Метод был предложен в 1938 году и стал известен благодаря работам сотрудников Французского института нефти. Предпринимались попытки улучшения данного синтеза, связанные преимущественно с технологическими особенностями и использованием различных катализаторов. Существенной чертой метода является выделение формальдегида при разложении 1,3-диоксана и связанное с этим образование смолы в установках по синтезу изопрена. Чтобы избежать подобных побочных процессов, предлагалось использовать различные химические аналоги формальдегида (метилаль, метилхлорметиловый эфир, диоксолан), а также генерировать его непосредственно при синтезе целевого продукта[6][7][8].
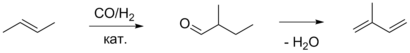
Также в качестве блока C4 может использоваться бутен-2. Его гидроформилирование в присутствии родиевого катализатора приводит к 2-метилбутаналю, который затем подвергается каталитической дегидратации под действием фосфата магния-аммония, молекулярных сит либо цеолитов, что приводит к изопрену. Данный метод не был реализован на промышленных предприятиях[9].
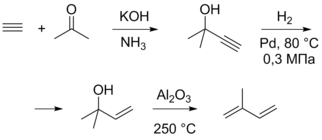
Синтез изопрена из блоков C2 и C3 был предложен Снампроджетти и использовался в Италии, давая 30 тыс. тонн изопрена в год. На первой стадии данного процесса происходит реакция между ацетоном и ацетиленом в присутствии KOH в жидком аммиаке при 10—40 °C и 20 бар. Продукт присоединения селективно гидрируется до алкена, после чего дегидратируется при 250—300 °C на оксиде алюминия, давая изопрен. Общая селективность в расчёте на ацетон и ацетилен составляет 85 %. Метод позволяет получать очень чистый изопрен, однако такое производство является относительно затратным[10][8].
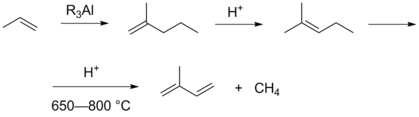
Промышленное получение изопрена путём димеризации пропилена, последующей изомеризации получаемого 2-метилпентена-1 в 2-метилпентен-2 и крекинга последнего в присутствии HBr с образованием метана и изопрена было воплощено на заводе в городе Бомонт (Техас), однако в 1975 году прекращено после пожара по причине роста цены на пропилен[10].
Интересным подходом к синтезу изопрена является метатезис бутена-2 с образованием пропилена и 2-метилбутена-2. Последний может быть дегидрирован различными известными способами. Недостаток данного подхода заключается в том, что поскольку в реакцию метатезиса могут вступать любые алкены, происходит образование разнообразных побочных продуктов. Особенно эта ситуация усугубляется при промышленных масштабах производства, когда в качестве исходного реагента используется более дешёвый технический бутен-2, содержащий примесь бутена-1[11].
Процессы дегидрирования[править | править код]
Реакции дегидрирования изопентана и изопентенов с образованием изопрена широко исследованы и напоминают аналогичные реакции получения бутадиена[12].
Одностадийный процесс дегидрирования изопентана под действием катализатора на основе Cr2O3/Al2O3 при 600 °C и 7 кПа даёт изопрен с выходом 52 %. Этот метод применялся в СССР. Дегидрирование изопентенов (метилбутенов) протекает под действием катализатора Shell (Fe2O3/K2CO3/Cr2O3) при 600 °C с выходом 85 %. Исходные углеводороды можно выделить из соответствующих перегонных фракций путём растворения в серной кислоте с последующим разложением эфира серной кислоты при 35 °C и обратной экстрацией изопентенов насыщенными углеводородами[12]. Данный подход применяется на заводах Shell, Arco и Exxon[13].
Получение из фракции C5[править | править код]
Фракция C5 является побочным продуктом крекинга углеводородов в процессе получения этилена. Она содержит небольшое количество изопрена, другие углеводороды с пятью атомами углерода в молекуле, а также ароматические углеводороды C6—C8. Такая смесь может быть перегнана с выделением изопрена, обычно в количестве 2—5 массовых % в пересчёте на этилен. Однако выход может быть увеличен, если в качестве исходного сырья использовать более тяжёлую фракцию. Если крекинг проводится в более жёстких условиях (при повышенной температуре и в течение более долгого времени), то выход изопрена уменьшается. Тем не менее такое ужесточение условий приводит к увеличению концентрации изопрена во фракции C5. Такое обогащение коммерчески выгодно, поскольку оно уменьшает затраты на транспортировку и получение чистого изопрена[12].
Перегонка фракции C5 не позволяет получить чистый изопрен, поскольку в смеси присутствуют некоторые компоненты, которые мало отличаются по температуре кипения. Для выделения чистого изопрена были предложены методы, основанные на отгонке азеотропной смеси с пентаном, а также методы с использованием экстракции селективными органическими растворителями (N-метилпирролидоном, диметилформамидом и ацетонитрилом)[14].
В целом, с точки зрения энергозатрат, выделение изопрена подобным способом гораздо выгоднее, нежели его химический синтез[15].
Экономические факторы[править | править код]
Ключевым фактором при планировании промышленного производства изопрена является месторасположение завода по разделению фракции C5, поскольку прибыльность зависит от возможности доставить эти фракции к месту разделения из нескольких заводов, на которых производится крекинг. Также необходимо учитывать необходимость утилизации остальных углеводородов из фракции C5[16].
По состоянию на 1987 год в Западной Европе производилось 83 000 тонн диенов C5, из них 44 000 тонн приходилось на димеризованный циклопентадиен и 23 000 тонн на изопрен. Остальные 15 000 тонн составляли пиперилены[16]. К 1997 году мировые объёмы производства изопрена возросли до 850 000 тонн в год, из них 180 тыс., 130 тыс. и 30 тыс. тонн производились в США, Японии и Западной Европе соответственно. Крупнейшим производителем изопрена является Goodyear (США, 61 тыс. тонн в год)[15].
Физические свойства[править | править код]
При стандартных условиях изопрен представляет собой бесцветную летучую жидкость. Изопрен практически не растворяется в воде (0,029 мол. %), но смешивается во всех соотношениях с этанолом, диэтиловым эфиром, ацетоном и бензолом. Изопрен образует азеотропные смеси с рядом органических растворителей[1].
Химические свойства[править | править код]
Согласно данным спектроскопических исследований, при 50 °C большинство молекул изопрена находится в более устойчивой s-транс-конформации, и только 15 % молекул имеют s-цис-конформацию. Разность энергий между этими состояниями составляет 6,3 кДж/моль[17].
По химическим свойствам изопрен представляет собой типичный сопряжённый диен, вступающий в реакции присоединения, замещения, циклизации, комплексообразования и теломеризации. По сравнению с бутадиеном, он более активно реагирует с электрофилами и диенофилами за счёт донорного индуктивного эффекта метильной группы[17].
Применение[править | править код]
Синтез полимеров[править | править код]

Бо́льшая часть производимого изопрена используется в синтезе цис-1,4-полиизопрена — изопренового каучука, который по свойствам и строению похож на природный каучук и широко применяется в производстве автомобильных шин. Другой продукт полимеризации изопрена — транс-1,4-полиизопрен — имеет свойства гуттаперчи и не находит широкого использования в промышленности, кроме изготовления шаров для гольфа и изоляции проводов[18].
Важную область применения изопрена составляет синтез блок-сополимеров типа стирол-изопрен-стирол. Подобные продукты используются как термопластические полимеры и адгезивы, чувствительные к давлению. Изопрен также используется в синтезе бутилового каучука — продукта сополимеризации изопрена с изобутиленом, где мольная доля изопрена составляет от 0,5 до 3,0 %[18].
Синтез терпенов[править | править код]
С 1972 года компанией Rhodia Incorporated (США) была начата разработка методов промышленного синтеза терпенов из изопрена, ацетона и ацетилена. Синтетическая схема включала в себя присоединение хлороводорода к изопрену с образованием пренилхлорида, который затем в две стадии превращали в дегидролиналоол. Последний служил в качестве исходного соединения для синтеза различных терпенов, например, линалоола, гераниола, цитраля, β-ионона и их производных. Позже завод был закрыт, однако японский производитель Kuraray продолжил выпускать по этой схеме не только указанные продукты, но также сквалан и другие соединения. Rhodia Incorporated разработала также способ синтеза лавандулола из двух молекул изопрена при помощи синтеза Гриньяра[19].
Природные терпены состоят из фрагментов изопрена, соединённых друг с другом по принципу «голова — хвост». Синтетические аналоги также должны иметь такую структуру, а также содержать двойные связи в определённых положениях. В связи с этим, промышленный синтез терпенов методами олигомеризации и теломеризации затруднён, и обычно пользуются другими подходами. Тем не менее предложен способ синтеза мирцена димеризацией изопрена на катализаторе (натрий/диалкиламин). Этот способ реализуется в промышленном масштабе компанией Nissan Chemical Industries. Теломеризация изопрена под действием диэтиламина и бутиллития в качестве катализатора приводит к N,N-диэтилнериламину, который далее может быть превращён в линалоол, гераниол, нерол, цитронеллаль, гидроксицитранеллаль и ментол[16].
Безопасность[править | править код]
В высоких концентрациях в отношении животных изопрен проявляет анестетические свойства с последующим параличом и летальным исходом. Изопрен не вызывает точечных мутаций в тесте Эймса. Метаболизм происходит, в основном, в дыхательной системе: при этом происходит превращение изопрена в соответствующие эпоксиды и затем диолы. Насыщение происходит при атмосферных концентрациях, равных 300—500 м д.[прояснить]; при более низких концентрациях скорость метаболизма прямо пропорциональна концентрации. Изопрен также синтезируется эндогенно: для мышей и крыс скорость синтеза оценивается в 0,4 и 1,9 мкмоль/(ч·кг) соответственно[20].
В высоких концентрациях изопрен оказывает на человека наркотическое действие, а также может вызывать раздражение кожи, глаз, слизистых оболочек и дыхательной системы. Предельно допустимая концентрация, установленная для изопрена в СССР, составляет 40 мг/м3[20].
Изопрен взрывоопасен и легко воспламеняется[7].
Биологическая роль[править | править код]
Изопрен в том числе в составе молекул других терпенов, встречается в разнообразных живых организмах: животных, растениях и микроорганизмах. В зависимости от организма число изопреновых фрагментов в молекуле терпена может составлять 1 (гемитерпены), 2 (монотерпены), 3 (сесквитерпены), 4 (дитерпены), 6 (тритерпены) или 8 (тетратерпены). В некоторых растениях обнаружены очень длинные терпены (каучук, гуттаперча), число звеньев изопрена в которых варьируется от нескольких тысяч до одного миллиона. Изопрен может также входить в состав других природных соединений неизопреноидного строения (например, прениллипидов), повышая их липофильность. Известно, что синтез изопреноидов в растениях осуществляется двумя независимыми путями: ацетат/мевалонатным путём (ацетат/MVA) (образуются полипренолы) и дезоксиксилозафосфат/метилэритритфосфатным путём (DOXP/MEP). Оба пути приводят к изопрену в виде так называемого «активного изопрена» — изопентенилпирофосфата (IPP), который под действием изомеразы может превращаться в изомерный 3,3-диметилаллилдифосфат (DMAPP). Сам изопрен получается из DMAPP при действии изопренсинтазы[21].


В середине XX века было обнаружено, что растения выделяют в атмосферу пары изопрена. Мировые объёмы выбросов фитогенного изопрена оцениваются в (180—450)⋅1012 г приведённого к массе углерода, содержащегося в соединении в год. Эмиссия изопрена листьями растений ускоряется при температуре выше 28 °C и при высокой интенсивности солнечного излучения, когда процесс фотосинтеза полностью насыщен. Подтвердить это явление или проверить, способно ли растение выделять изопрен, можно при помощи спектроскопии в ультрафиолетовой области или путём анализа газов в газовом хроматографе, комбинированном с масс-спектрометром. Биосинтез изопрена ингибируется фосмидомицином, а также соединениями ряда статинов[22].
Физиологическая роль выделения растениями изопрена до конца не выяснена. Изопрен обеспечивает растениям повышенную устойчивость к перегреванию. Кроме того, как потенциальный уловитель радикалов, он может защищать растения от разрушающего воздействия озона и активных форм кислорода. Предполагается также, что поскольку синтез изопрена требует постоянной затраты молекул АТФ и НАДФН, образующихся в процессе фотосинтеза, он таким образом сохраняет фотосистемы от перевосстановления и фотоокислительного разрушения в условиях чрезмерного освещения. Недостатком такого механизма защиты является то, что углерод, связываемый растениями в процессе фотосинтеза, выбрасывается путём выделения изопрена[23].
Из гомологического ряда диеновых углеводородов изопрен является наиболее часто встречающимся диеновым углеводородом в организме человека. По некоторым оценкам, скорость синтеза изопрена в организме человека составляет около 0,15 мкмоль/(кг·ч), что соответствует приблизительно 17 мг в сутки для человека массой 70 кг. Изопрен также присутствует в ничтожных концентрациях во многих пищевых продуктах[источник не указан 3581 день].
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 Ullmann, 2000, p. 84.
- ↑ C. G. Williams Proceedings of the Royal Society (1860) 10.
- ↑ 1 2 M. J. Loadman. Analysis of Rubber and Rubber-like Polymers (неопр.). — Springer, 2012. — С. 10. — ISBN 9789401144353.
- ↑ Winfried R. Pötsch (Federführung); Annelore Fischer; Wolfgang Müller. Lexikon bedeutender Chemiker. Unter Mitarb. von Heinz Cassebaum. Frankfurt am Main, Deutsch, 1989, 470 S. ISBN 3-8171-1055-3.
- ↑ Ullmann, 2000, p. 83—84.
- ↑ Ullmann, 2000, p. 85—86.
- ↑ 1 2 Химическая энциклопедия, 1990.
- ↑ 1 2 Industrial Organic Chemistry, 2008, p. 120.
- ↑ Ullmann, 2000, p. 86—87.
- ↑ 1 2 Ullmann, 2000, p. 87.
- ↑ Ullmann, 2000, p. 87—88.
- ↑ 1 2 3 Ullmann, 2000, p. 88.
- ↑ Industrial Organic Chemistry, 2008, p. 118.
- ↑ Ullmann, 2000, p. 90.
- ↑ 1 2 Industrial Organic Chemistry, 2008, p. 117.
- ↑ 1 2 3 Ullmann, 2000, p. 94—95.
- ↑ 1 2 Ullmann, 2000, p. 85.
- ↑ 1 2 Ullmann, 2000, p. 92—93.
- ↑ Ullmann, 2000, p. 93—94.
- ↑ 1 2 Ullmann, 2000, p. 98.
- ↑ Herrmann, 2010, p. 12—17.
- ↑ Herrmann, 2010, p. 22—27.
- ↑ Herrmann, 2010, p. 31—33.
Литература[править | править код]
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 191—192.
- The Chemistry and Biology of Volatiles / Edited by A. Herrmann. — Wiley, 2010. — ISBN 9780470777787.
- Weissermel K., Arpe H.-J. 1,3-Diolefins // Industrial Organic Chemistry. — 4th ed.. — Wiley, 2008. — P. 107—126. — ISBN 9783527619191. — doi:10.1002/9783527619191.ch5.
- Weitz H. M., Loser E. Isoprene (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a14_627.
- Каримов Э. Х., Касьянова Л. З., Мовсумзаде Э. М., Даминев Р. Р., Каримов О. Х., Ялалов М. Р. Совмещение процессов окисления и дегидрирования изоамиленов в производстве изопрена на железокалиевом катализаторе // Теоретические основы химической технологии. 2016. Т. 50. № 1. С. 95.
- Karimov E. K., Kas’yanova L. Z., Movsumzade E. M., Daminev R. R., Karimov O. K., Yalalov M. R. Combination of oxidation and dehydrogenation processes of isoamylenes in the production of isoprene on iron potassium catalyst // Theoretical Foundations of Chemical Engineering. 2016. Т. 50. № 1. С. 92—96.
Ссылки[править | править код]
- Sigma-Aldrich. ИК-спектр изопрена. Дата обращения: 1 апреля 2014.
- Sigma-Aldrich. КР-спектр изопрена. Дата обращения: 1 апреля 2014.
- Sigma-Aldrich. ЯМР-спектр изопрена. Дата обращения: 1 апреля 2014.