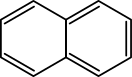
Нафталин
| Нафталин | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Нафталин | ||
| Традиционные названия | Нафталин, антимит, гексален | ||
| Хим. формула | С10Н8 | ||
| Рац. формула | С10Н8 | ||
| Физические свойства | |||
| Молярная масса | 128,17052 г/моль | ||
| Плотность |
1,14 г/см3 (15,5 °C); 1,0253 г/см3 (20 °C); 0,9625 г/см3 (100 °C)[1] |
||
| Энергия ионизации | 8,12 ± 0,01 эВ[2] и 1,3E−18 Дж[3] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 80,26 °C | ||
| • кипения | 217,97[1] °C | ||
| • вспышки | 79—87 °C | ||
| Пределы взрываемости | 0,9 ± 0,1 об.%[2] | ||
| Мол. теплоёмк. | 165,72[1] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | 78,53[1] кДж/моль | ||
| Давление пара | 0,08 ± 0,01 мм рт.ст.[2] | ||
| Оптические свойства | |||
| Показатель преломления | 1,5898[1] | ||
| Структура | |||
| Дипольный момент | 0 Кл·м[3] | ||
| Классификация | |||
| Рег. номер CAS | 91-20-3 | ||
| PubChem | 931 | ||
| Рег. номер EINECS | 202-049-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | QJ0525000 | ||
| ChEBI | 16482 | ||
| ChemSpider | 906 | ||
| Безопасность | |||
| Предельная концентрация | 20 мг/м³ | ||
| ЛД50 | 5000-12376 мг/кг | ||
| Токсичность | Зарегистрированные препараты нафталина относятся к 4-му классу опасности для человека, оказывают общетоксическое действие. | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Нафтали́н (бицикло-[4.4.0]-дека-1,3,5,7,9-пентаен, гексален, антимит) — органическое соединение состава C10H8. Представляет собой твёрдое кристаллическое вещество с характерным запахом. В воде мало растворим. Хорошо растворим в бензоле, эфире, спирте, хлороформе.
Химические свойства[править | править код]

Нафталин по химическим свойствам сходен с бензолом: легко нитруется, сульфируется, взаимодействует с галогенами. Отличается от бензола тем, что легче вступает в реакции[4].
Физические свойства[править | править код]
Плотность 1,14 г/см³, температура плавления 80,26 °C, температура кипения 217,7 °C, растворимость в воде примерно 30 мг/л, температура вспышки 79—87 °C, температура самовоспламенения 525 °C, молярная масса 128,17052 г/моль, давление пара (при температуре 80 °C) 1040 Па.
Электропроводность[править | править код]
Кристаллический нафталин имеет заметную электропроводность при комнатной температуре с удельным сопротивлением около 1012 Ом·м. При плавлении удельное сопротивление уменьшается более чем в тысячу раз, примерно до 4·108 Ом·м.
Как в жидком, так и в твёрдом виде сопротивление зависит от температуры приблизительно как , где (Ом·м) и (эВ) — некоторые постоянные параметры, — постоянная Больцмана (8,617·10−5 эВ/K), а — абсолютная температура (K). Параметр равен 0,73 эВ в твёрдом нафталине. В твёрдом виде имеет полупроводниковый тип проводимости при температуре даже ниже 100 К[5][6].
Получение[править | править код]
Нафталин получают из каменноугольной смолы.
Также нафталин можно выделять из тяжёлой смолы пиролиза (закалочное масло), которая применяется в процессе пиролиза на этиленовых установках. Ещё одним способом промышленного получения нафталина является деалкилирование его алкилпроизводных.
В природе нафталин выделяют термиты вида Coptotermes formosanus, чтобы защитить свои гнёзда от муравьёв, грибков и нематод[7].
В Восточной Европе нафталин производится различными интегрированными металлургическими комплексами (Северсталь, Евраз, Мечел, ММК) в России, специализированными производителями нафталина и фенола ИНКОР, Енакиевским металлургическим заводом на Украине и АрселорМиттал Темиртау в Казахстане.
Применение[править | править код]
Важное сырьё химической промышленности: применяется для синтеза фталевого ангидрида, тетралина, декалина, разнообразных производных нафталина.
Производные нафталина применяют для получения красителей и взрывчатых веществ, в медицине, как инсектицид моли в быту.
Крупные монокристаллы применяются в качестве сцинтилляторов для регистрации ионизирующих излучений.
Может использоваться для создания синтетических аналогов каннабиноидов.
Влияние на здоровье[править | править код]
При остром отравлении нафталин вызывает головные боли, тошноту, рвоту, раздражение слизистых оболочек. Длительное воздействие нафталина может вызвать повреждение или разрушение красных кровяных телец (эритроцитов). Хроническое воздействие нафталина также приводит к нарушению работы печени и поджелудочной железы, вызывает развитие атрофического ринита и фарингита.
Международное агентство по изучению рака (IARC) классифицировало нафталин как возможный канцероген людей и животных (Group 2B).
В человеческом организме чаще всего концентрируется в жировой ткани, где может накапливаться до тех пор, пока жировая ткань не начнёт сжигаться, и данное вещество (нафталин) не попадёт в кровь, после чего наступает отравление организма (кровотечения, возникновение опухолей и т. д.).
Исследование в 2022 году показало, что в комнате с компьютером уровни содержания в воздухе полициклических ароматических углеводородов (ПАУ) были в 2—2,5 раз выше, чем на открытом воздухе или в помещении без компьютера. Преобладающими были такие токсичные вещества как нафталин и фенантрен.[8]
Производные[править | править код]
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 3 4 5 CRC Handbook of Chemistry and Physics / D. R. Lide (Ed.). — 90th edition. — CRC Press; Taylor and Francis, 2009. — 2828 p. — ISBN 1420090844.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0439.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Нафталин // Химическая энциклопедия
- ↑ John A. Bornmann (1962): «Semiconductivity of Naphthalene». Journal of Chemical Physics, volume 36, pages 1691— doi:10.1063/1.1732805
- ↑ L. B. Schein, C. B. Duke, and A. R. McGhie (1978): «Observation of the Band-Hopping Transition for Electrons in Naphthalene». Physical Review Letters, volume 40, pages 197—. doi:10.1103/PhysRevLett.40.197
- ↑ Термиты травят муравьёв нафталином. Дата обращения: 18 мая 2014. Архивировано 26 апреля 2017 года.
- ↑ Sung-Hee Seo, Kuen-Sik Jung, Min-Kyu Park, Hye-Ok Kwon, Sung-Deuk Choi. Indoor air pollution of polycyclic aromatic hydrocarbons emitted by computers (англ.) // Building and Environment. — 2022-06-15. — Vol. 218. — P. 109107. — ISSN 0360-1323. — doi:10.1016/j.buildenv.2022.109107.
Литература[править | править код]
- Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с.


![{\displaystyle \rho =\rho _{0}\ \exp[E/(kT)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/567576e8080598839bf3164a83eb3f79ea2500a8)



